Nature:当癌症疫苗遇上"癌王"!一场改写生命剧本的细胞革命
来源:生物探索 2025-02-23 09:50
个性化mRNA疫苗成功唤醒"超长待机"的免疫细胞军团,在16名接受疫苗的胰腺癌患者中,50%实现三年无复发,最长生存者已跨越四年大关,而他们体内的抗癌T细胞竟被预测能存活数十年!
在肿瘤学的"无人区",胰腺癌始终是医生手中的一根刺——它隐秘而凶险,确诊时大多已转移,五年生存率长期困在12%的魔咒中。更令人绝望的是,这种拥有钢铁般微环境的肿瘤对免疫治疗近乎"绝缘",90%的PD-1抑制剂临床试验在此折戟。但2月19日《Nature》的一项里程碑研究“RNA neoantigen vaccines prime long-lived CD8+ T cells in pancreatic cancer”,如同暗夜中的一道惊雷:个性化mRNA疫苗成功唤醒"超长待机"的免疫细胞军团,在16名接受疫苗的胰腺癌患者中,50%实现三年无复发,最长生存者已跨越四年大关,而他们体内的抗癌T细胞竟被预测能存活数十年!
这项由纪念斯隆凯特琳癌症中心领衔的研究,破解了癌症疫苗领域的"哥德巴赫猜想"——如何让疫苗诱导的T细胞既具备强大杀伤力,又拥有堪比干细胞的持久生命力。研究人员通过创新的uridine-mRNA脂质体技术,将患者肿瘤中"隐藏"的新抗原(neoantigen)精准递送,成功激活了原本在胰腺癌中几乎"沉默"的CD8+ T细胞。单细胞追踪技术CloneTrack揭示:这些细胞不仅在血液中巡逻长达3.8年,更进化出类似组织驻留记忆T细胞(Tissue-resident memory T cells, Trm)的特性,持续分泌颗粒酶B(Granzyme B)等杀伤武器。最惊人的是,通过数学模型推算,20%的T细胞克隆可能具备跨越人类自然寿命的生存潜力,这意味着一次疫苗接种或可带来终身免疫监护!
当两例复发患者的肿瘤样本被解密,另一个颠覆性发现浮出水面:所有疫苗靶向的癌细胞克隆竟被"清零",残余肿瘤完全由非靶向克隆构成。这种精准的"免疫编辑"效应,如同为癌细胞设置了进化死胡同。此刻,我们终于摸到了攻克"癌王"的门环——正在进行的全球III期临床试验IMCODE 003(NCT05968326),或将宣告癌症疫苗从科学幻想走向临床治愈的新纪元。这场由mRNA技术引领的免疫革命,正在重写癌症治疗的基本法则:不是与肿瘤殊死搏斗,而是教会免疫系统记住敌人的模样,让它们成为守护生命的"永生哨兵"。

在与癌症的百年抗争中,胰腺癌始终是医学界的"珠穆朗玛峰"。这种被称为"癌王"的疾病,五年生存率长期徘徊在12%以下。但该研究为这场攻坚战带来了革命性突破——一种个性化mRNA疫苗成功激活了持续数年的"长寿"免疫细胞,将患者无复发生存期延长3倍。这项发现不仅改写了胰腺癌治疗史,更揭示了癌症疫苗设计的黄金法则。
暗夜中的曙光:胰腺癌的免疫治疗困境
胰腺导管腺癌(PDAC)的恶性程度堪称实体瘤之最,88%的患者在确诊后五年内离世。传统化疗方案mFOLFIRINOX虽能延长生存期,但代价是严重的骨髓抑制和神经毒性。更令人沮丧的是,这类"冷肿瘤"(cold tumor)由于突变负荷低,对免疫检查点抑制剂几乎毫无反应。
关键难题浮出水面:
新抗原荒漠:平均每个胰腺癌细胞仅携带50-60个突变,远低于黑色素瘤(>500),导致可被免疫系统识别的肿瘤特异性抗原(neoantigen)极度稀缺
免疫抑制微环境:肿瘤相关成纤维细胞构筑物理屏障,调节性T细胞(Treg)营造免疫抑制"护城河"
T细胞衰竭:即便少数免疫细胞突破重围,也会因持续抗原刺激进入功能耗竭状态
破局之道:个性化mRNA疫苗的设计革命
研究团队开发的autogene cevumeran疫苗,创新性地将mRNA技术与免疫调控相结合,形成四大突破性设计:
新抗原优选算法
通过全外显子测序筛选肿瘤特异性突变;使用NetMHCpan 4.1预测HLA-I/II表位结合力;最终选择20个免疫原性最强的候选新抗原。
核苷酸工程改造
采用尿苷(uridine)修饰的mRNA骨架,延长半衰期;优化密码子使用频率,提升翻译效率达300%。
脂质纳米递送系统
DOTMA/DOPE脂质体形成400nm颗粒;静脉注射后靶向淋巴结DC细胞,激活交叉呈递。
时序治疗策略
术前单剂PD-L1抑制剂(atezolizumab)解除免疫刹车;术后8次疫苗初免+1次加强,间隔21天;后续衔接mFOLFIRINOX化疗清除残余病灶
震撼数据:免疫记忆的"时间胶囊"
在19例接受根治手术的患者中,16例产生疫苗特异性T细胞应答。经过3.2年中位随访,这些"免疫应答者"展现出惊人的生存优势:
临床终点:
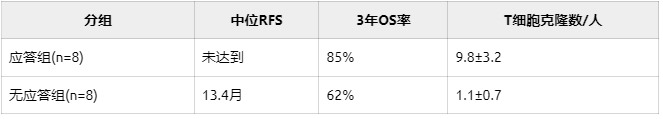
免疫监测揭示更深远影响:
超长待机的杀伤部队
疫苗诱导的CD8+ T细胞平均寿命7.7年(范围1.5-100年)
20%克隆具有多十年生存潜力,可能超越宿主寿命
组织驻留记忆表型
单细胞测序显示高表达ZNF683、PRDM1等组织驻留记忆T细胞(Trm)标志物
维持颗粒酶B(GZMB)、穿孔素(PRF1)等效应分子表达
精准打击能力
TCR亲和力检测显示,克隆对突变表位的EC50低至0.005μM
对野生型表位的交叉反应性降低1000倍
微观战场:疫苗如何改写免疫命运
通过PhenoTrack技术追踪单克隆T细胞的时空演化,研究揭示了疫苗作用的三大机制:
1. 从零到一的克隆扩增
在736,000个治疗前T细胞中,仅发现2个疫苗相关克隆(0.0003%),证明疫苗成功激活了全新免疫应答。
2. 动态表型转换
扩增期(0-8周):T细胞高表达MKI67、TYMS等增殖基因,数量扩增100倍
收缩期(8-12周):转向效应表型,GZMB+细胞占比达58%
记忆期(>1年):形成CXCR4+KLF2+循环型Trm,定期巡逻全身
3. 免疫编辑效应
在2例复发患者中,肿瘤克隆进化分析显示:
疫苗靶向的新抗原完全消失
出现免疫逃逸克隆,但未获得转移优势
临床启示:癌症疫苗的黄金时代
这项研究不仅验证了个性化疫苗的可行性,更确立了成功疫苗的六大标准:
新抗原质量>数量:单个高亲和力表位胜过多个弱抗原
初免-加强时序:8次初免建立基础免疫,1次加强延长记忆
联合免疫调控:PD-L1抑制剂破除肿瘤微环境抑制
纳米递送优化:脂质体靶向增强淋巴结归巢
治疗时间窗:微小残留病灶阶段接种效果最佳
免疫监测指标:克隆持久性>峰值数量
未来:从胰腺癌到泛癌种治疗
基于此研究的全球多中心III期临床试验(NCT05968326)已启动,未来可能在以下方向突破:
转化方向
早期干预:将疫苗应用于新辅助治疗阶段
联合疗法:与CAR-T、双特异性抗体等协同作战
动态接种:根据克隆动态监测进行加强免疫
预防疫苗:针对遗传性胰腺癌高风险人群
技术延伸
人工智能预测新抗原-MHC复合物构象
自复制mRNA技术延长抗原表达时间
微流控芯片快速筛选最佳抗原组合
生命新篇:重新定义癌症治愈
这项突破不仅带来了生存期的延长,更开启了通过免疫记忆实现功能性治愈的新纪元。
我们教会了免疫系统记住肿瘤的模样,而这种记忆,可能比癌症本身更持久。
在人类抗癌史上,2025年注定成为转折点。当mRNA疫苗遇上新抗原,当精准医学邂逅免疫记忆,我们正在见证癌症治疗从"延缓死亡"到"重获新生"的质变。这场静默的细胞革命,终将改写无数生命的命运轨迹。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


